近日,國家藥監(jiān)局藥品審評中心(CDE)公示,百濟(jì)神州自主研發(fā)的新一代BCL2抑制劑索托克拉(sonrotoclax)的上市申請獲受理,并納入優(yōu)先審評程序,適應(yīng)癥為既往接受過治療的慢性淋巴細(xì)胞白血病(CLL)/小淋巴細(xì)胞淋巴瘤(SLL)成人患者。這是繼澤布替尼后,百濟(jì)神州在血液腫瘤領(lǐng)域的又一自研產(chǎn)品,或?qū)⒊蔀閲鴥?nèi)首款獲批的國產(chǎn)BCL2抑制劑。
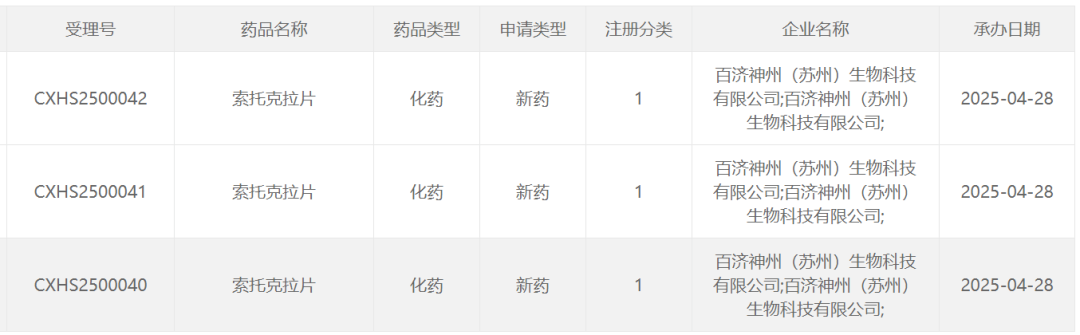
圖片來源:CDE 官網(wǎng)
CLL/SLL是成人最常見的血液腫瘤之一,中國年新增患者約7000-8000例,中位發(fā)病年齡65歲。盡管BTK抑制劑等靶向藥已開啟“無化療”治療時代,但患者仍面臨緩解深度不足、高危群體生存期短、長期用藥依從性差等挑戰(zhàn)。
BCL2蛋白作為調(diào)控細(xì)胞凋亡的關(guān)鍵因子,其過表達(dá)是腫瘤細(xì)胞逃逸死亡的核心機(jī)制之一。全球首款BCL2抑制劑維奈克拉(Venetoclax)雖已在國內(nèi)上市,但存在半衰期長、耐藥性等問題。索托克拉的差異化設(shè)計瞄準(zhǔn)了這一痛點:臨床前研究顯示,其效力較維奈克拉高10倍以上,且半衰期短、蓄積風(fēng)險低,潛在安全性更優(yōu)。
根據(jù)2024年EHA年會披露的1期數(shù)據(jù),索托克拉聯(lián)合澤布替尼治療復(fù)發(fā)/難治性CLL患者的客觀緩解率(ORR)達(dá)97%,完全緩解(CR)率50%,且所有患者在第48周均達(dá)到微小殘留病灶陰性(uMRD4)。在套細(xì)胞淋巴瘤(MCL)適應(yīng)癥中,聯(lián)合用藥的CR率高達(dá)91%。目前,百濟(jì)神州已圍繞索托克拉開展多項聯(lián)合澤布替尼的全球臨床試驗,覆蓋一線治療、固定周期方案等場景。
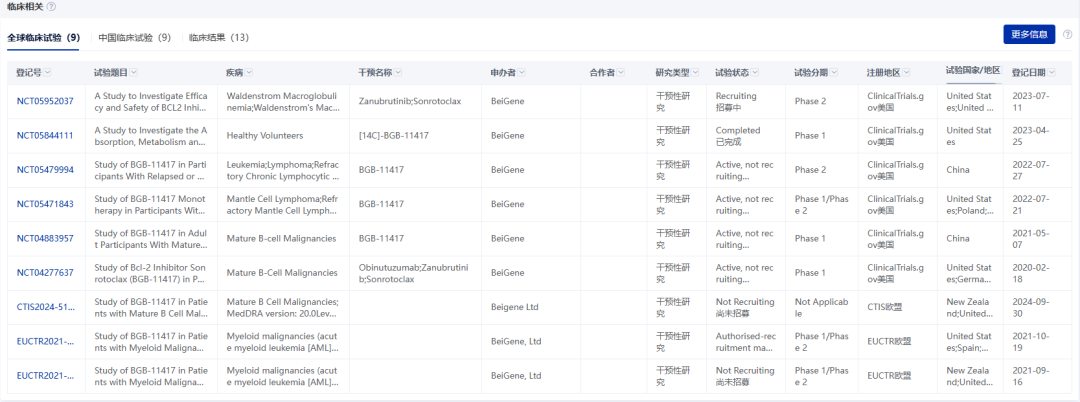
圖片來源:藥智數(shù)據(jù)企業(yè)版——全球藥物分析系統(tǒng)
全球BCL2抑制劑市場長期由維奈克拉主導(dǎo),2023 年全球銷售額超 160 億人民幣。國內(nèi)競爭中,索托克拉若憑借優(yōu)先審評通道加速獲批,不僅將填補(bǔ)國產(chǎn)BCL2抑制劑空白,更可能通過“澤布替尼+索托克拉”的聯(lián)合療法構(gòu)建護(hù)城河,推動CLL治療從“終身服藥”向“有限周期”模式轉(zhuǎn)變。
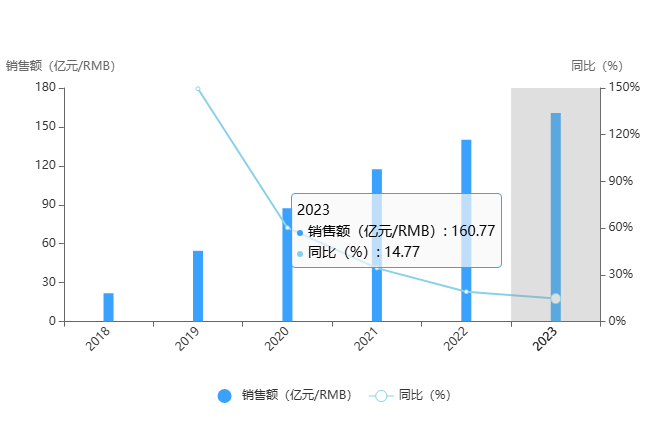
圖片來源:藥智數(shù)據(jù)企業(yè)版——全球暢銷藥銷售數(shù)據(jù)
在BD出海受國際形式波動影響的背景下,國產(chǎn)創(chuàng)新藥企正加速轉(zhuǎn)向內(nèi)源性突破。索托克拉的申報,既是百濟(jì)神州管線厚度的又一次驗證,也折射出中國藥企在血液腫瘤領(lǐng)域從“跟隨”到“并跑”的進(jìn)階。其后續(xù)商業(yè)化表現(xiàn),或?qū)⒅厮車鴥?nèi)BCL2抑制劑市場格局。







