2025年3月11日,Arvinas和輝瑞共同宣布了ARV-471的3期VERITAC-2臨床試驗結果,結果顯示其雖在ESR1突變中發揮了非常不錯的療效,但對于ESR1野生型患者卻敗下陣來。
2025年6月2日,ARV-471在2025年ASCO大會上首次公布了其臨床Ⅲ期的詳細報告,進一步驗證了其在ESR1突變的有效性與安全性,顯著優于氟維司群(標準療法)。
2025年6月6日,美國食品藥品監督管理局(FDA)就收到了ARV-471的上市申請,用于治療既往接受過內分泌治療的“ER陽性/HER2陰性、ESR1突變”的晚期或轉移性乳腺癌患者,標志著PROTAC這一創新療法成功走出了臨床階段。
20年來,PROTAC這個備受關注的創新藥技術,有過被追捧的日子,也有過被看低的時候,如今首款PROTAC的上市已然在即,ARV-471仍是ESR1突變乳腺癌領域全面超越傳統療法的里程碑產品,有望在未來繼續重塑整個乳腺癌治療格局!
為什么
PROTAC能超越傳統療法?
乳腺癌作為全球發病率最高的惡性腫瘤,根據其致病基因類型大致分為四種,即Luminal A型、Luminal B型、HER2過表達型與三陰型,其中雌激素受體陽性(ER+)乳腺癌占比最高(70%左右),理論上應是乳腺癌中最大的細分市場。
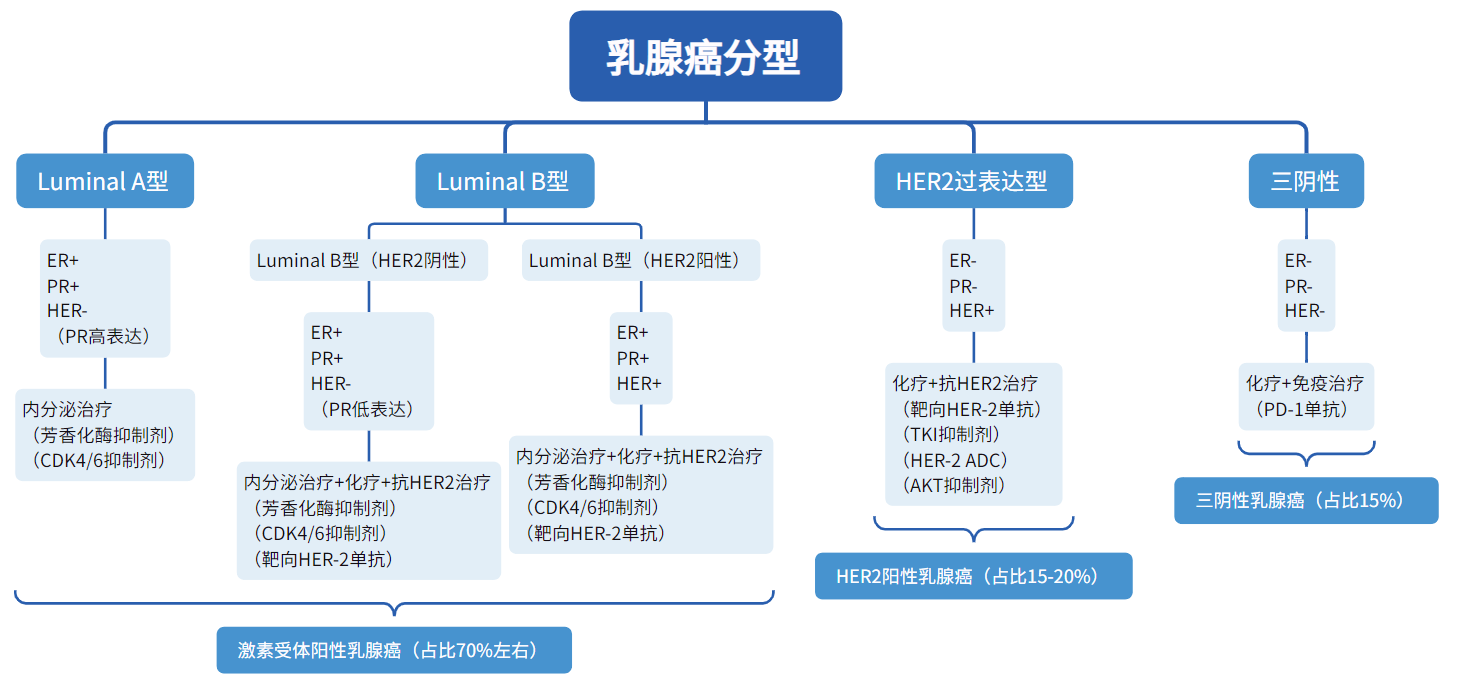
數據來源:公開數據整理
同時,由于ER陽性乳腺癌對激素的嚴格依賴,臨床上HER-2單抗、PD-1單抗等熱門新藥的整體效果不佳,指南中建議的治療藥物主要為常規內分泌藥物與CDK4/6抑制劑兩大類。
其中,能直接抑制ER信號通路的療法又可細分為三類,即芳香化酶抑制劑,選擇性ER調節劑和選擇性ER下調劑。
芳香化酶抑制劑:可阻斷雄激素轉化為雌激素,將抑制絕經后女性體內90%以上殘留的雌激素。代表藥物有來曲唑、依西美坦等。
選擇性ER調節劑通過與雌激素受體形成穩定的復合物,從而使腫瘤細胞的生長受到抑制。代表藥物有他莫昔芬(TAM)、托瑞米芬。
選擇性ER下調劑(SERDS)則是通過下調ER水平和活性,全面抑制ER信號通路,代表藥物為氟維司群。
更關鍵的是,這幾類藥物對于初治型患者的療效相對顯著,Luminal A型5年生存率接近95.0%、Luminal B型5年生存率接近了77.5%,因此對于該類患者而言,其臨床需求重點已不再局限于“無藥可用”,反而是如何進一步提高該疾病乳腺癌的生存周期,即將5年生存率指標提升至10年生存率。而這其中首先需要解決的就是上述藥物后續的耐藥性問題。
而近年來,隨著生物技術的發展,多個新型ER靶點藥物涌現,其中備受追捧的PROTAC技術在ER+乳腺癌領域展現出無限的治療潛力,就為解決ER+乳腺癌耐藥難題提供了一種全新的思路。
三大優勢
奠定PROTAC的獨特性
原則上來講,PROTAC就像是“房產中介”,其一端與目標蛋白結合,另一端與細胞內的E3泛素連接酶結合,將一個個需要“出售房產”腫瘤細胞打上標記,然后蛋白酶體就會將這些被標記的蛋白分解掉(買下來)。
其與傳統內分泌治療相比,在機制上實現了三大突破:
首先,與傳統小分子抑制劑基于“占據驅動”的作用機制不同,PROTAC遵循“事件驅動”機制,與靶蛋白的結合也并不局限于占據蛋白的“結合口袋”,理論上,只要與靶蛋白任意部位結合,便能實現整個靶蛋白的降解,而非單純抑制其功能。
其次,在常規小分子抑制劑治療過程中,當靶蛋白發生突變時,可能導致小分子與靶蛋白的結合受阻,進而產生對突變體的耐藥性,而PROTAC與靶蛋白的結合不受此類突變影響,因此其在應對小分子耐藥性方面具備顯著優勢。
最后,不同于傳統小分子抑制劑的劑量依賴性,PROTAC可以在引發蛋白降解后即從復合物中分離,并進入下一個催化循環,理論上可在較低濃度下實現大部分靶蛋白的降解,藥物作用效率高,有望延長藥物作用時間。在ARV-471一項Ib期聯合哌柏西利研究中,其ESR1突變亞組中位PFS達13.7個月,反應持續時間14.6個月。
從這方面來看,PROTAC已不僅僅是一款創新藥種類,更像是一項可組合的技術,將重新定義耐藥性乳腺癌治療。
自證之路
ARV-471邁入上市之路
作為臨床進度最快的PROTAC產品,ARV-471背負的既有醫藥產業對PROTAC技術的期待,也有眾多ESR1突變耐藥乳腺癌的希望。
在其關鍵的VERITAC-2三期臨床試驗中,Vepdegestrant展現出令人振奮的療效數據。這項涉及全球25個國家、624名患者的開放標簽研究,專門針對曾接受CDK4/6抑制劑和內分泌治療后仍進展的難治性患者。
實驗中,270名攜帶ESR1突變的患者中,對比了ARV-471與氟維司群的臨床有效性與安全性,結果顯示ARV-471的多項數據均明顯優于后者。
ARV-471 VS 氟維司群的III期臨床效據
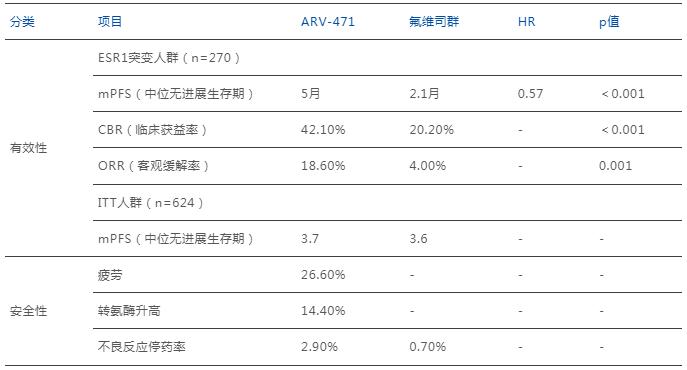
數據來源:公開數據整理
其中,ARV-471的中位無進展生存期(PFS)達5個月,顯著優于氟維司群對照組的2.1個月,將疾病進展或死亡風險降低43%;實驗組客觀緩解率(ORR)達18.6%,是對照組的4倍多(4.0%);臨床獲益率(CBR)達42.1%,同樣顯著高于對照組的20.2%。
安全性方面,Vepdegestrant表現出良好的耐受性。最常見的不良反應為疲勞(26.6%)、轉氨酶升高(14.4%)等,大多為1-2級。僅2.9%患者因不良反應停藥,這一數據與對照組相當(0.7%)。
綜合而言,ARV-471最大意義并非替代部分臨床療法,而是破解了ESR1突變耐藥困境,滿足其迫切的臨床需求。
紛至沓來
乳腺癌PROTAC繼續進軍
在乳腺癌領域中,當初ARV-471是第一個進入臨床期研發階段的PROTAC藥物,如今去其多半又是第一個獲批上市的PROTAC藥物,它的問世,猶如一塊投入平靜湖面的巨石,在乳腺癌治療領域激起了層層漣漪,產生了深遠且廣泛的影響。
更關鍵的是,在ARV-471仍有眾多PROTAC創新療法還在積極推進中。
部分乳腺癌PROTAC管線與臨床階段
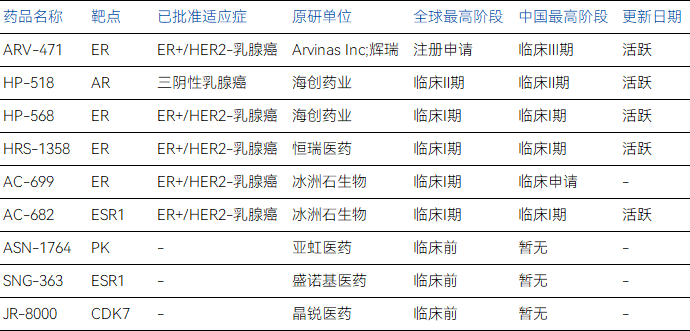
數據來源:藥智數據、藥智咨詢整理
其中,繼ARV-471之后,乳腺癌PROTAC領域幾乎被中國藥企所占領,恒瑞醫藥、海創醫藥與冰洲石生物正是其中顯著代表。
恒瑞醫藥:HRS-1358
HRS-1358是恒瑞醫藥自研的一款ER靶點PROTAC新藥,其能夠強效且高選擇性地降解ER,抑制ER轉錄活性及下游信號,進而抑制腫瘤細胞增殖,發揮抗腫瘤作用。其也是嚴格對標ARV-471的一款PROTAC產品。
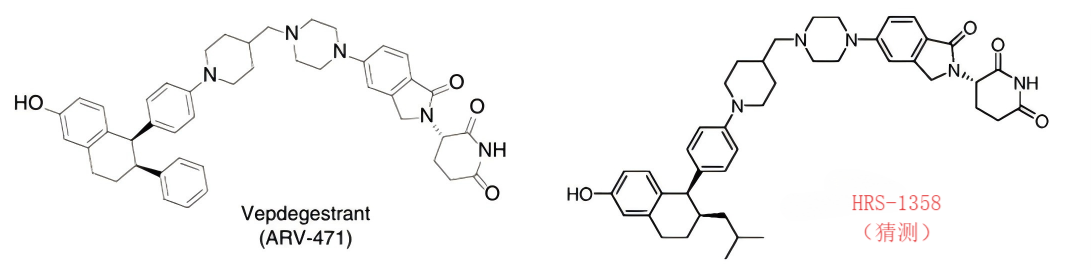
圖注:左為ARV-471結構式;右為預估HRS-1358的結構式
圖片來源:Innodrugs
2022年11月,該藥首次獲批開展臨床試驗。
2024年7月,HRS-1358獲批開啟了與新型高選擇性CDK4/6抑制劑羥乙磺酸達爾西利片的聯合臨床試驗。
2024年10月,HRS-1358獲批開啟了聯合HRS-2189(選擇性CDK4抑制劑)和HRS-6209用于惡性腫瘤的治療。
目前,該藥已處于臨床I/Ⅱ期階段,整體進度略低于其另一款AR靶點PROTAC新藥HRS-5041,截至2024年,HRS-1358相關項目累計投入研發費用已超過7300萬元。
冰洲石生物:AC682/AC699
作為國內少數專注PROTAC技術的創新企業,成立于國內創新藥開始萌芽的2015年,誕生之初就聚焦于“AI+醫藥研發”方向,旨在使用AI技術賦能的藥物研發環節包括靶點發現、苗頭化合物識別和驗證、先導化合物的識別、優化和臨床選擇,是一家典型的醫藥研發型企業。
在PROTAC技術方向,冰洲石生物一共有4款PROTAC管線進入了臨床,其分別是AC0699、AC0682,AC0176,AC0676,其中AC0699與AC0682為靶向ER,AC0176為靶向AR,AC0676則是靶向BTK。

圖片來源:冰洲石生物官網
目前,AC0699與AC0682作為ERα嵌合降解劑,正處于I期臨床試驗中。2024年6月,ASCO大會上AC699單藥治療晚期或轉移性乳腺癌患者的I期研究初步結果得以公布,其客觀緩解率(ORR)為21%,其中ESR1突變患者的ORR達到了50%。被投資者認為具有成為領域內BIC藥物的潛力。
而根據其過往與Evommune進行人工智能藥物研發合作的經歷來看,其根本上是一家兼具自主研發與技術服務商的多維角色,至少短期內其管線后續發展(如臨床后期研究、商業化)都不太可能獨自承擔,此次PROTAC的成藥性驗證,對其而言或許也不失為開拓License-out的大好機會。
海創醫藥:HP-518/HP-568
海創醫藥作為國內擁有PROTAC靶向蛋白降解技術平臺的優質Biotech企業,其自2016年起開始建設PROTAC技術平臺,在多個腫瘤靶點進行PROTAC新藥開發,目前一共擁有兩款臨床階段的PROTAC產品,分別是靶向“AR”的HP-518與靶向“ER”的HP-568。

圖片來源:海創醫藥官網
HP518作為中國首款進入臨床階段的口服AR PROTAC在研藥物,具有解決AR突變前列腺癌耐藥性的潛力。在早期動物實驗中,其對野生型AR及恩扎盧胺耐藥的變異AR都有很高的降解活性,開發的主要適應癥方向為前列腺癌與乳腺癌。目前,該藥的I期臨床試驗在澳大利亞開展,用于AR陽性三陰乳腺癌并獲美國FDA授予快速通道認定。
HP568作為海創醫藥新的一款靶向ER的PROTAC藥物,擬與HP518形成差異化競爭,用于治療雌激素受體陽性和人表皮生長因子受體2陰性的晚期乳腺癌(ER+/HER2-晚期乳腺癌)。早期臨床前研究結果顯示,HP568通過特異性催化ERα發生蛋白酶體依賴的快速降解發揮其抗增殖活性,HP568對ERα野生型(wild-type,WT)蛋白和臨床常見的ERα突變蛋白均具有極強的降解活性。目前,該藥已進入臨床I期階段。
當然,PROTAC技術的布局方向絕不局限于乳腺癌領域,在其他腫瘤、免疫和炎癥性疾病中,其也擁有不俗的實力,其整體進度反而略優于乳腺癌,比如:
百濟神州靶向BTK的BGB-16673,已于2025年2月啟動了治療BTK和BCL-2經治CLL的3期研究,是目前全球PROTAC在研管線中僅次于ARV-471的存在。
賽諾菲靶向IRAK4的KT-474目前已處于2期臨床開發階段,用于治療化膿性汗腺炎(HS)和特應性皮炎(AD)。
Nurix靶向BTK的NX-5948,目前也已處于1b/2期臨床開發階段,擬用于治療復發/難治性華氏巨球蛋白血癥。
總體來看,目前PROTAC領域中進入臨床階段的在研管線靶點超過10個,AR與BTK是目前整體最快的兩個靶點,同時也是新藥布局最高的靶點領域之一,而目前受ARV-471上市申請的事件影響,其成藥性驗證成功無異于是一劑PROTAC領域的強心針,有望為后續諸多管線帶來更多的目光,尤其是資本。
展望
PROTAC能否繼續進階
盡管短期來看PROTAC技術的前景似乎一片光明,尤其是如今首款PROTAC產品的成藥性驗證成功,但其實PROTAC作為一項新興技術療法,背后仍有諸多挑戰需要面臨,比如:
生物利用度難題:口服PROTAC分子需要克服細胞膜屏障,確保有效細胞內遞送。
組織特異性局限:目前PROTAC依賴的E3連接酶(如CRBN和VHL)在全身廣泛表達,可能帶來脫靶風險。
劑量效應復雜性:與傳統藥物不同,PROTAC可能呈現“鉤狀效應”,與劑量非線性關系,這既是優點也是缺點。
療效有限:當前研究中,ESR1突變患者的中位PFS為5個月,但僅比氟維司群對照組的數據高2月,臨床替代意義不那么明顯,仍有巨大的提升空間。
對此,醫藥研究者正在積極探尋PROTAC的進階療法,包括開發新型E3連接酶配體以提高組織特異性、采用抗體偶聯降解劑(DAC)技術實現精準遞送、無連接子PROTAC、RIPTAC、PROTAB等等。
以抗體偶聯降解劑(DAC)為例,其是將靶向蛋白降解劑與單克隆抗體通過連接子偶聯起來的新分子模式。與傳統ADC產品有著相似的結構與作用機制,唯一的不同就是有效載荷從細胞毒性藥物變成了PROTAC。
而DAC新分子之所以被稱為PROTAC的進階療法,其主要由于其兼具了PROTAC的催化特性與ADC的組織特異性,原則上DAC能在較低劑量下實現有效地降解目標蛋白,既克服了靶向降解劑靶向性不足,也克服了ADC的高毒藥物的毒性局限性,更關鍵的是其還擁有了耐藥性回避與更廣泛的適用性。
事實上,近年來已有不少企業開始布局這一創新技術療法,但整體進展緩慢且失敗率較高,比如艾伯維的ABBV-787,而其發展緩慢的原因則主要受限于PROTAC領域本身的發展未得到臨床充分驗證。而目前,隨著首款PROTAC分子成功走出臨床,后續基礎技術領域的研究深入,DAC發展或許有望進一步提速。
小結
總結而言,ARV-471的上市標志著PROTAC技術從實驗室走向臨床的里程碑,為ER+乳腺癌患者,尤其是ESR1突變耐藥群體提供了突破性的治療選擇。
盡管其療效(中位PFS 5個月)的數據并未達到跨越性增長,但通過?催化降解ER蛋白?的機制革新,PROTAC已證明其解決耐藥性難題的獨特價值。
未來,隨著中國藥企(如恒瑞的HRS-1358、冰洲石的AC699)加速布局,以及?DAC技術?對組織特異性的優化,PROTAC有望進一步穩固其“耐藥后線療法”的基石地位,并逐步向一線治療逐步前行,甚至是在全腫瘤領域中全面開花。
當然,作為創新療法的一員,其遼闊未來的另一面也是其面臨的巨大挑戰,比如生物利用度困難與組織特異性局限等問題,未來,希望在基礎研究水平上漲的助力之下,PROTAC能成為下一個十年乳腺癌“去耐藥化”的核心驅動力,最終實現從“延長生存”到“功能性治愈”的愿景。







