6月23日,默沙東宣布其新型非核苷類巨細胞病毒(CMV)抑制劑普瑞明?(來特莫韋)兩種劑型——來特莫韋片和來特莫韋注射液,已獲中國國家藥品監督管理局(NMPA)批準,用于接受異基因造血干細胞移植(HSCT)的巨細胞病毒(CMV)血清學陽性的成人和6個月及以上且體重≥6kg的兒童受者[R+]預防巨細胞病毒感染和巨細胞病毒病。這標志著普瑞明?(來特莫韋)成為國內首個且目前唯一可用于接受HSCT成人和兒童患者的CMV預防方案,為相關兒童患者提供精準的感染防控新選擇。

圖片來源:默沙東官微
巨細胞病毒在人群中廣泛存在,卻對造血干細胞移植患者構成致命威脅。我國成人移植患者術前CMV血清陽性率高達92%,若不預防干預,80%的患者會在術后100天內出現病毒激活,導致間質性肺炎、移植物抗宿主病甚至死亡。而兒童患者因免疫系統未成熟,風險更高:嬰幼兒期抗體陽性率達60%-80%,移植后病毒復燃風險顯著增加。雖然搶先治療是控制CMV的有效方法,但仍有很多異基因HSCT受者會出現難治性巨細胞病毒感染問題,且搶先治療藥物存在骨髓抑制、腎毒性等不良反應問題,增加了患者的死亡風險和醫療負擔。
普瑞明?的突破性在于其創新機制與關口前移理念,它通過抑制病毒DNA剪切和包裝,阻斷病毒復制,且與傳統藥物無交叉耐藥限制。
《新英格蘭醫學雜志》發表的來特莫韋III期研究顯示,移植后14周,普瑞明?組有臨床意義的CMV感染率較安慰劑降低83.5%,24周仍降低57.3%;
同時,在安全性方面,普瑞明?不良事件發生率與安慰劑組相似,無骨髓抑制、無腎毒性增加;
意大利真實世界研究證實,移植當天啟動預防治療100天,CMV復燃和CMV病發生率分別下降82%和83%。
中國每年造血干細胞移植患者中,兒童占比近25%。此前,這部分群體缺乏安全有效的CMV預防方案,臨床需求長期未被滿足。此次普瑞明?獲批擴展用于兒童患者,進一步豐富了普瑞明?在華適應證組合,支持臨床滿足對不同年齡段患者的CMV預防性治療需求。
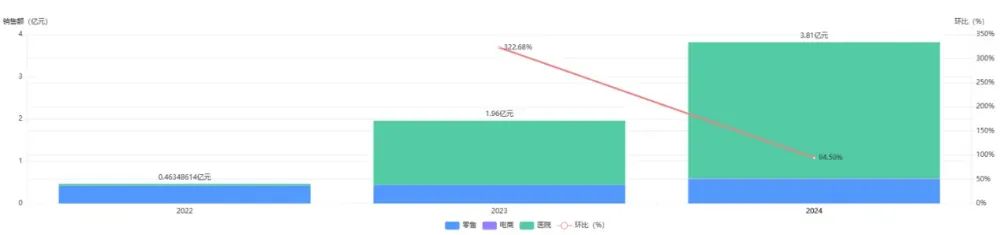
2022年普瑞明?在中國上市后,不足一年即納入國家醫保目錄,2023年3月1日執行的新版目錄覆蓋其片劑及注射液;市場表現穩步提升。藥智數據顯示,2024年,該藥物在國內的銷售額已接近4億元人民幣。據預測,其在華年銷售額有望突破5億美元,成為僅次于HPV疫苗Gardasil的抗感染產品。
圖片來源:藥智數據——藥品市場全終端分析系統
此次兒童適應癥獲批,是默沙東鞏固抗感染領導地位的關鍵落子,亦是對沖核心產品專利危機的未雨綢繆。
2024年默沙東全球收入642億美元,其中腫瘤藥物占56%(Keytruda單藥貢獻294.8億美元),疫苗占22%;
核心產品Keytruda專利將于2028年到期,公司亟需新增長點;
普瑞明?與抗真菌藥艾沙康唑等形成圍移植期感染防護矩陣,同時通過收購Prometheus加碼自免領域,構建多元化管線。
普瑞明?的持續放量將助力默沙東在CMV預防領域形成壟斷性優勢。此次獲批后,默沙東預計將依托現有渠道快速覆蓋全國血液中心,填補兒童預防市場空白。







